Wetenschap en innovatie
Het CAHAL en innovatie
Door de jaren heen zijn binnen het CAHAL nieuwe diagnostische technieken ontwikkeld om de behandeling van patiënten met aangeboren hartafwijkingen te optimaliseren, enkele voorbeelden zijn:
- 3-dimensionaal printen van harten van patiënten, zodat congenitaal hartchirurgen en (kinder-)interventiecardiologen zich goed kunnen voorbereiden op de behandeling van een hartafwijking.
- Advanced imaging, MRI – 4D flowmetingen bij Fontan patiënten. Projecten met betrekking tot beeldvorming van het hart (‘advanced imaging’), zoals een 4-dimensionale flow MRI en echocardiografische studies voor en na hartoperaties en tijdens de vroege stadia van zwangerschap.
- Homemonitoring traject, dit biedt de mogelijkheid voor ouders met een baby met een ernstige aangeboren hartafwijking thuis af te wachten op een vervolg operatie.
- Gestandaardiseerde meting van zuurstof spanning bij een pasgeboren kind voor de vroege detectie van aangeboren hartafwijkingen (POLAR-studie). In samenwerking met stichting Hartekind is financiering verkregen om deze methode voor het opsporen van aangeboren hartafwijkingen uit te voeren in heel Nederland.
- Het CAHAL is een van de grootste centra ter wereld met de toepassing van een eHealth programma voor volwassen patiënten met een aangeboren hartafwijking.
- Om patiënten met aangeboren hartafwijkingen beter te begeleiden gedurende het leven is binnen het CAHAL een zorgpad aangeboren hartafwijkingen ontwikkeld en worden kinderen in het follow-me programma gevolgd waarbij ook gekeken wordt naar kwaliteit van leven en neurocognitieve ontwikkeling. Daarnaast heeft het CAHAL een speciale transitiepolikliniek voor de overdracht van een patiënt op de leeftijd van 18 jaar van de kindercardioloog naar de congenitaal cardioloog.
Het CAHAL en wetenschap
Binnen het CAHAL vinden wij onderzoek belangrijk, daarom wordt er veel onderzoek gedaan naar aangeboren hartafwijkingen en hartritmestoornissen, enkele voorbeelden zijn:
- De CONCOR database voor landelijke registratie van volwassenen met aangeboren hartafwijkingen is binnen het CAHAL gehuisvest. Hierin zijn geanonimiseerde gegevens van ruim 17.000 volwassenen met aangeboren hartaandoeningen opgeslagen. Deze database wordt landelijk gebruikt voor diverse onderzoeksprojecten.
- PReCOR database, die alle CAHAL foetussen met hartaandoeningen registreert. Inmiddels zijn de medische gegevens van meer dan 1.000 foetussen opgeslagen. Dit helpt om wetenschappelijk onderzoek te doen, bijvoorbeeld naar hoe we meer afwijkingen vroegtijdig kunnen opsporen en de prognose beter kunnen voorspellen.
- Sinds 2014 verzamelen we in het Heart and Neuro Development (HAND-) programma de beelden van de hersenontwikkelingen van ongeboren kinderen. Veel kinderen met congenitale hartaandoeningen hebben een kleinere hoofdomtrek en een achterstand in neurocognitieve ontwikkeling. Met behulp van Artificial Intelligence (AI) is er onderzoek gedaan waaruit blijkt dat de placenta een grote rol speelt bij achterblijvende hoofdgroei.
- Onderzoek naar de oorzaak, behandeling en preventie van hartritmestoornissen bij ongeboren kinderen, kinderen en volwassenen.
- Het toepassen van eHealth en wearables bij volwassenen met aangeboren hartaandoeningen.
- Onderzoek naar de kwaliteit van leven bij volwassen patiënten met aangeboren hartaandoeningen.
- Het coördineren van de multicenter studie naar afwijkende kransslagaders (‘coronairen’) in Nederland, de MuSCAT studie.
- Het decellulariseren van donor-hartkleppen, in samenwerking met de Nederlandse hartkleppenbank.
- Onderzoek naar de rol van (pathologische) cardiale autonome innervatie in het kader van substraat voor aritmiën.
- Onderzoek naar rechter systeemkamer harten, met aandacht voor klinische uitkomsten, hartfalen en behandelstrategieën om de lange termijn uitkomsten te verbeteren.
Door de jaren heen hebben al deze onderzoeksprojecten geleid tot meer dan 1500 publicaties in peer reviewed (inter-)nationale tijdschriften en zijn er meer dan 100 mensen gepromoveerd binnen het CAHAL
Onderstaand vindt u meer informatie over onderzoek en innovatie projecten binnen het CAHAL.
Aortopathy in Congenital Heart Disease: Impact and Pathogenesis
The influence of altered left ventricular-to-aortic flow angle on the aortic wall: an ex vivo flow model study
Boudewijn P.T. Kruithof, PhDa,b,c , Anouk Schuitemaker, BScb , Arno A.W. Roest, MD PhDd , Monique R.M. Jongbloed, MD, PhDa,e , Marie-José Goumans, PhDb , Nina Ajmone Marsan, MD PhDa , Roel L.F. van der Palen, MD PhDd*
a – Department of Cardiology, Leiden University Medical Center, Leiden, The Netherlands
b – Department of Cell and Chemical Biology, Leiden University Medical Center, Leiden, The
Netherlands
c – Netherlands Heart Institute, Utrecht, The Netherlands
d – Division of Pediatric Cardiology, Department of Pediatrics, Leiden University Medical Center, Leiden, The Netherlands
e – Department of Anatomy & Embryology, Leiden University Medical Center, Leiden, The Netherlands
* Principal investigator of the project
Introduction
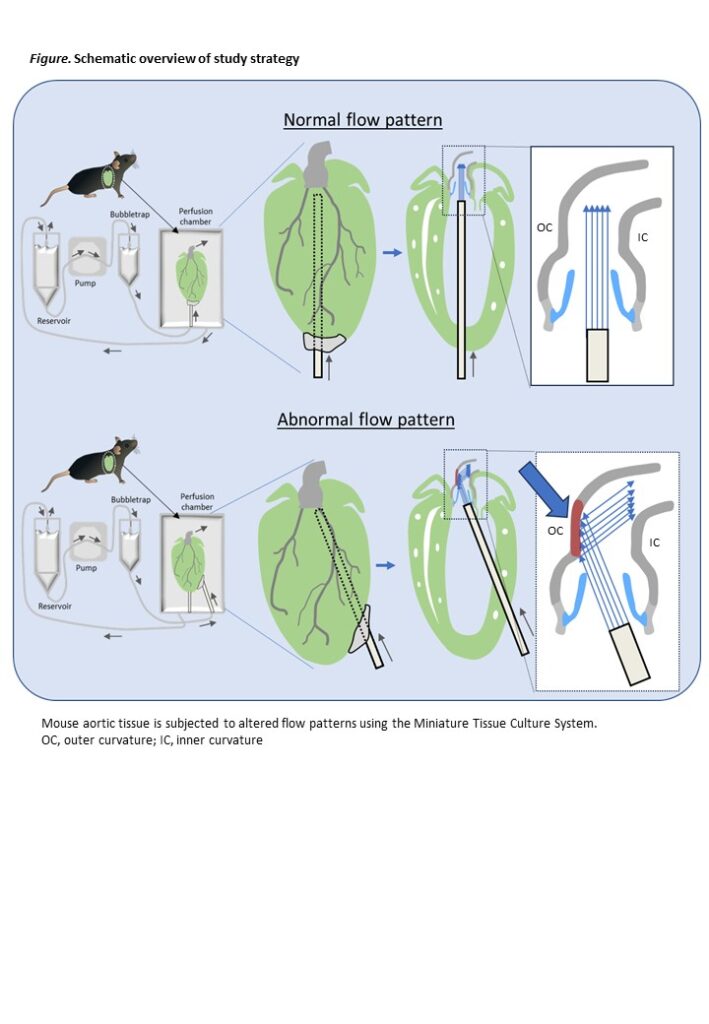
With increased survival following corrective surgery for congenital heart defects (CHD), attention has shifted from immediate mortality to long-term complications, including aortic dilation, aneurysm formation, and valvular insufficiency. Among the factors contributing to aortic dilation in CHD patients, we have previously shown that altered geometry of the left ventricular outflow tract (LVOT) significantly influences hemodynamics in the ascending aorta, particularly in patients with a bicuspid aortic valve or those who have undergone surgical correction for transposition of the great arteries (TGA) or atrioventricular septal defects 1-4 . Despite these findings, the cellular mechanisms by which abnormal LVOT hemodynamics affect the aortic wall remain poorly understood. To address this gap, we propose to study the impact of left ventricular-to-aortic flow angulation and subsequent altered hemodynamics on the ascending aorta at both the cellular and molecular levels. The Miniature Tissue Culture System (MTCS) is a recently developed ex vivo flow model for whole mouse hearts 5-9, in which the complex valve and aortic anatomy is preserved enabling the creation of specific hemodynamic stresses, that closely mimic the in vivo situation, in intact aortic tissue. In this study, we will use the MTCS and aim to elucidate the effect of specific hemodynamic stresses on aortic wall structure.
Methods
To study the downstream effect of altered LVOT flow on the aortic wall, mouse aortas were cultured in the MTCS. To mimic the situation after TGA correction in which the outer curvature of the aorta is subjected to a jet flow resulting in higher shear stress and pressure, and the inner curvature is subjected to a “non-jet” flow with more oscillatory shear stress and lower pressure, the needle of the flow system was placed with a specific angle just beneath the aortic valve. This was achieved by directing the needle with a specific angle and at a specific area through the left ventricular wall. The needle was then secured using biocompatible glue. The aortas were cultured for 7 days with a flow rate of 10 ml/min. At the end of the culture the flow was shortly visualized using a dye (Evans Blue), followed by fixation of the aorta and subsequent histological analysis. Cultured aortas with abnormal flow pattern were compared with non-cultured hearts.
Results
We measured the thickness of the aortic wall (intima and media) on sections stained for elastin and observed an increase in wall thickness both in the inner and outer curvature of the cultured aorta. Staining for the endothelial cell marker PECAM-1 showed an intact endothelial cell lining in the non-cultured aortas, whereas in the cultured aortas, breakage of the endothelial cell lining was observed in the ascending aorta just downstream of the sinotubular junction. The endothelial lining in the downstream aortic arch region was still intact. Quantification of the endothelial cell coverage of the aorta showed that the outer curvature (Jet side) was more affected than the inner curvature (Non-jet side). To determine whether an abnormal flow pattern would result in activation of specific signaling pathways, sections were stained for phospho-p38MAPK (pp38MAPK), phosho-SMAD1/5/9 (pSMAD1/5/9) and phospho-AKT (pAKT) which are activated signaling molecules that integrate and process various extracellular signals. Whereas pp38MAPK is observed in the endothelial lining of non-cultured aortas, we observed upregulation of pp38MAPK specifically in the adventitia and in the mostly luminal part of the media predominantly at the outer curvature. Expression of pp38MAPK in the endothelial cells was not observed anymore in the cultured aortas. pSMAD1/5/9 staining showed a different pattern with mostly expression in the adventitia, whereas pAKT was mostly expressed in the outer lining of the adventitia. Similar to the breakage of the endothelial lining, the upregulation of the studied signaling molecules was mostly limited to the ascending aorta, indicating that the jet-flow induced activation of specific cellular processes.
Conclusion
The results indicate that abnormal flow patterns in cultured aortas lead to increased wall thickness and significant endothelial disruption, particularly in the outer curvature of the ascending aorta. This altered flow pattern activates specific signaling pathways, predominantly in the adventitia and the outer curvature, suggesting that jet-flow plays a critical role in initiating cellular responses and aorticwall remodeling.
References
1. van der Palen RLF, Deurvorst QS, Kroft LJM, van den Boogaard PJ, Hazekamp MG, Blom NA, Lamb HJ, Westenberg JJM and Roest AAW. Altered Ascending Aorta Hemodynamics in Patients After Arterial Switch Operation for Transposition of the Great Arteries. J Magn Reson Imaging. 2020;51:1105-1116
2. van der Palen RLF, Juffermans JF, Kroft LJM, Hazekamp MG, Lamb HJ, Blom NA, Roest AAW and Westenberg JJM. Wall shear stress in the thoracic aorta at rest and with dobutamine stress after arterial switch operation. Eur J Cardiothorac Surg. 2021;59:814-822
3. Van Ooij P, Markl M, Collins JD, Carr JC, Rigsby C, Bonow RO, Malaisrie SR, McCarthy PM, Fedak PW, Barker AJ. Aortic Valve Stenosis Alters Expression of Regional Aortic Wall Shear Stress: New Insights From a 4-Dimensional Flow Magnetic Resonance Imaging Study of 571 Subjects. J Am Heart Assoc.2017;6:e005959
4. Elders B, Westenberg JJW, van den Boogaard P, Calkoen E, Blom NA, Kroft L, de Roos A and Roest AAW. Altered ascending aortic wall shear stress in patients with corrected atrioventricular septal defect: a comprehensive cardiovascular magnetic resonance and 4D flow MRI evaluation. Cardiol Young. 2019;29:637-642
5. Kruithof BPT, Lieber SC, Kruithof-de Julio M, Gaussin V and Goumans MJ. Culturing Mouse Cardiac Valves in the Miniature Tissue Culture System. J Vis Exp. 2015:e52750
6. Kruithof BPT, Paardekooper L, Hiemstra YL, Goumans MJ, Palmen M, Delgado V, Klautz RJM and Ajmone Marsan N. Stress-induced remodelling of the mitral valve: a model for leaflet thickening and superimposed tissue formation in mitral valve disease. Cardiovasc Res. 2020;116:931-943
7. Kruithof BPT, van de Pol V, Los T, Lodder K, Gourabi BM, DeRuiter MC, Goumans MJ, Ajmone Marsan N. New calcification model for intact murine aortic valves. J Mol Cell Cardiol. 156:95-104, 2021
8. Kruithof BPT, Mousavi Gourabi B, Van de Merbel AF, DeRuiter MC, Goumans MJ. A new ex vivo model to study cardiac fibrosis in whole mouse hearts. JACC: Basic to Translational Science 2024;9:1005-1022
9. De Boer RA and Ardehali R. Exploring Cardiac Fibrosis: A Novel Ex Vivo Model Using Whole Mouse Hearts. JACC: Basic to Translational Science 2024;9:1023-1025
15th Rembrandt symposium, Rembrandt Institute of Cardiovascular Science (1 November 2024, Noordwijkerhout, The Netherlands)
Optimization Fetal-to-Neonatal Transition in Congenital Heart Disease
Physiological-based cord clamping and early oxygenation in infants with Transposition of the Great Arteries using a new purpose-built resuscitation table: a feasibility study
Jesse A. Weeda, MD1,2,8, Arjan B. te Pas, MD, PhD2,8, Zsuzsanna Nagy, MD3,4, Stuart B. Hooper, PhD5 ,Gábor H. Kovács, MD6, Miklós Szabó MD3, PhD, Monique C. Haak MD, PhD7,8, Nico A. Blom MD, PhD1,8, Roel L.F. van der Palen, MD, PhD1,8
- Division of Pediatric Cardiology, Department of Pediatrics, Willem-Alexander Children’s
Hospital, Leiden University Medical Center (LUMC), Leiden, The Netherlands - Division of Neonatology, Department of Pediatrics, Willem-Alexander Children’s Hospital,
Leiden University Medical Center (LUMC), Leiden, The Netherlands - Department of Neonatology, Pediatric Centre, Semmelweis University, Budapest, Hungary
- Department of Obstetrics and Gynaecology, Pediatric Centre, Semmelweis University,
Budapest, Hungary - Department of Obstetrics and Gynaecology, Monash Children’s Hospital, Melbourne,
Australia - Department of Pediatric Cardiology, Gottsegen National Cardiovascular Center, Budapest,
Hungary - Department of Obstetrics and Fetal Medicine, Leiden University Medical Center (LUMC),
Leiden, The Netherlands - Center for Congenital Heart Disease Amsterdam-Leiden (CAHAL), The Netherlands.
Explainer video: Stichting Hartekind
Objectives: Infants with Transposition of the Great Arteries (TGA), especially with intact ventricular
septum (TGA-IVS), are highly susceptible for developing pulmonary hypertension (PPHN) after birth. Physiologically based cord clamping (cord clamping until after lung aeration has been established; PBCC), proven beneficial in term infants, leads to a more stable cardiovascular adaptation with improved oxygenation. It could therefore decrease the risk for PPHN in TGA-newborns. We assessed the feasibility of combining PBCC while administering extra oxygen immediately after birth.
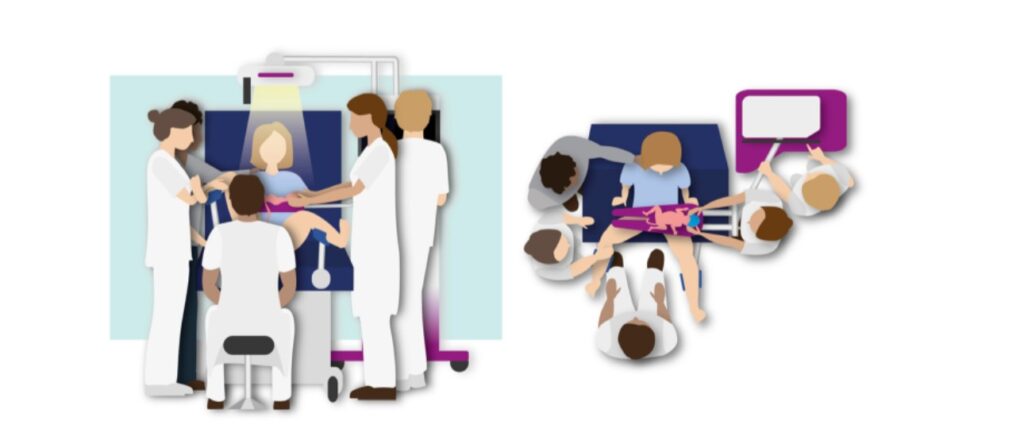
Methods: The stabilisation approach was performed at the Leiden University Medical Center from January – September 2023. Newborns with TGA were stabilised on a new purpose-built resuscitation table (Concord; Figure), provided with standard stabilisation equipment. All newborns received supplemental oxygen (initially 2L High Flow with fraction of inspired oxygen (FiO 2 ) of 1.0). Cord clamping was performed when the infant was stable (Heart rate (HR) >100 bpm along with spontaneous breathing while receiving oxygen therapy) with minimum of 3 and maximum of 10 minutes until cord clamping. Continuous HR, oxygen saturation (SpO 2 ), 5 and 10-minute Apgar scores and temperature at admission were determined.
Results: So far, eight infants (75% male) were included, of which 3/8 (37%) had ventricular septal
defects (VSD). Vaginal delivery occurred in 6/8 (75%), with median (IQR) gestational age of 39 (37-40) weeks and birth weight of 3.3 (2.8-3.5) kg. PBCC was successful in all 8 infants with cord
clamping time of 9.2 (3.8-10.5) min. There were no maternal or neonatal adverse events during
stabilisation. Preductal SpO 2 values were 60% (51-69%), 66% (42-82%) and 79% (76-88%) at 3, 5 and 10 minutes after birth. HR levels were 157 (117-168), 164 (137-180) and 156 (135-170) bpm,
respectively. Following initial stabilisation, all vaginally born term infants were able to have skin-to-skin contact with their mother for at least 10 minutes with continuous monitoring and supplemental oxygen. Two infants (25%) required NO-therapy for pulmonary hypertension within the first 24 hours after birth.
Conclusion: Combining early oxygenation with PBCC using the Concord in TGA-newborns is feasible. No adverse events were observed during stabilisation; HR remained stable, and SpO 2 increased gradually with early oxygen supply.
Presented at the 57th Annual Meeting of the Association for European Paediatric and Congenital Cardiology (8-11 May 2024, Porto, Portugal)
MuSCAT: Multicenter Study on Coronary Anomalies in The Netherlands
De Multicenter Study on Coronary Anomalies in The Netherlands (MuSCAT studie) doet onderzoek naar patiënten met aberrante coronairen. Enerzijds wordt gekeken naar de diagnostiek, behandeling en follow-up van patiënten met aberrante coronair arteriën met een oorsprong vanuit de tegenovergestelde sinus van Valsalva (ACAOS). Daarnaast is een registratie opgezet waarin patienten worden geïncludeerd met aberrante coronair arteriën die ontspringen uit de pulmonaal arterie en coronair arterioveneuze fistels (CAVF).
Patienten met aberrante coronair arteriën met een oorsprong vanuit de tegenovergestelde sinus van Valsalva kunnen zich presenteren met thoracale pijnklachten, dyspnoe of duizeligheid/(pre-)syncope bij intensieve inspanning. Daarnaast wordt het regelmatig als toevalsbevinding gevonden. Sporadisch uit dit zich met een hartstilstand.
Wanneer de diagnose van een aberrante coronair wordt gesteld volgen verschillende onderzoeken om te kunnen beoordelen of er sprake is van een benigne of maligne beloop. Huidige richtlijnen adviseren de anatomische kenmerken te beoordelen en ischemie detectie te verrichten. De modaliteiten die hiervoor gebruikt worden verschillen echter per centrum. De MuSCAT studie heeft als doel op basis van wetenschappelijk bewijs het optimale diagnostisch en behandel traject vast te stellen. Hierin worden ook nieuwe diagnostische modaliteiten meegenomen.
Voor het volledige protocol verwijs ik u naar de publicatie in de Netherlands Heart Journal1.
MuSCAT inclusie criteria:
- Aberrante coronair met een afgang uit de tegenovergestelde sinus van Valsalva (ACAOS)
- Aberrante linker of rechter coronair arteriën met een afgang uit de pulmonaal arterie (ALCAPA/ARCAPA)
- Coronair arterioveneuze fistels (CAVF)
- Informed consent (afgenomen tijdens 1e poli bezoek in een MuSCAT centrum)
MuSCAT exclusie criteria:
- Hemodynamisch significante congenitale hartafwijkingen anders dan ACAOS, ALCAPA, ARCAPA en/of CAVF
- Bewezen significant atherosclerotisch coronairlijden in de ACAOS
MuSCAT centra: CAHAL-LUMC, CAHAL-Amsterdam UMC, UMC Utrecht, Erasmus MC, Medisch Spectrum Twente, Radboud UMC, Sint Antonius Ziekenhuis en het Amphia Ziekenhuis.
Voor meer vragen of het verwijzen van patienten kunt u zich wenden tot muscat@lumc.nl.
- Koppel, C. J., et al. “The first multicentre study on coronary anomalies in the Netherlands: MuSCAT.” Netherlands Heart Journal (2021): 1-7.
Leiden Convention
Het “Leiden Convention” coderingssysteem voor kransslagaders
Er is veel variatie in de anatomie en in het beloop van de kransslagaders, die het hart van bloed voorzien. In veruit de meeste gevallen komen uit de grote lichaamsslagader (aorta) twee kransslagers (coronair-arteriën): de rechter coronairarterie (RCA) en de linker coronairarterie (LCA). Beide ontspringen aan hun eigen kant van de aorta (Afbeelding 1). Bij ongeveer 1% van de mensen is er variatie van de manier waarop de kransslagaders uit de aorta ontspringen. Zo kan de LCA bijvoorbeeld uit de RCA komen. Bij patiënten met een aangeboren hartafwijking wordt vaker variatie in het kransslagaderpatroon gezien dan bij mensen met een structureel normaal hart.
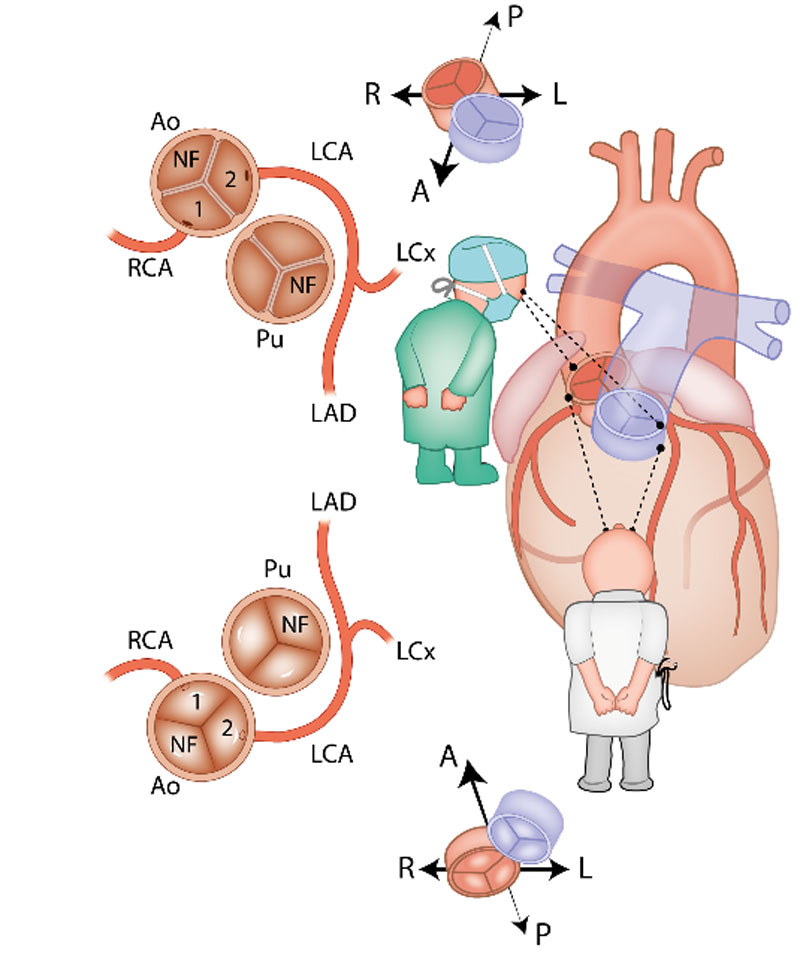
Complexe kransslagaderpatronen, zeker in combinatie met een aangeboren hartafwijking, kunnen het lastig maken om de kransslagaderanatomie duidelijk te beschrijven. Dit komt doordat de ligging van de kransslagaders in de borstkas soms niet meer ‘echt’ links- of rechtszijdig is, bijvoorbeeld doordat het hart gedraaid in de borstkas ligt of omdat de stand van de grote vaten (de aorta en de stam van de longslagader) afwijkend is. Om ook in deze gevallen de kransslagaderanatomie eenduidig te kunnen beschrijven is in de jaren ’80 van de vorige eeuw het zogenaamde ‘Leiden Convention’ coderingssysteem ontwikkeld door prof. dr. Adriana Gittenberger-de Groot. Initieel werd dit systeem gemaakt voor patiënten met een ‘transpositie van de grote vaten’ (de longslagader en de grote lichaamsslagader ontspringen vanuit de verkeerde kamer uit het hart). Het systeem is nadien nog enkele malen aangepast en is in alle harten (dus zowel structureel normaal als afwijkend) bruikbaar. Van het systeem bestaat een aparte variant voor chirurgen en interventiecardiologen en een variant die kan worden toegepast door cardiologen die beeldvorming van het hart gebruiken, zoals een CT-scan en een echocardiogram. De reden dat er twee varianten zijn, is omdat de methode voor de chirurg gebaseerd is op het bekijken van het hart vanaf bovenaf (zoals een chirurg tijdens een operatie). De methode voor een echo of CT-scan is gebaseerd op het hart bekijken vanaf onder (Afbeelding 1). De uiteindelijke manier van opschrijven (de “codering”) is voor beide varianten hetzelfde. Hieronder volgt een uitleg van het Leiden Convention Coronair Coderingssysteem, volgens beide varianten (dus voor chirurg/interventiecardioloog en voor toepassing bij beeldvorming zoals CT-scan en echocardiogram).
Methode van het “Leiden Convention” Coronair coderingssysteem.
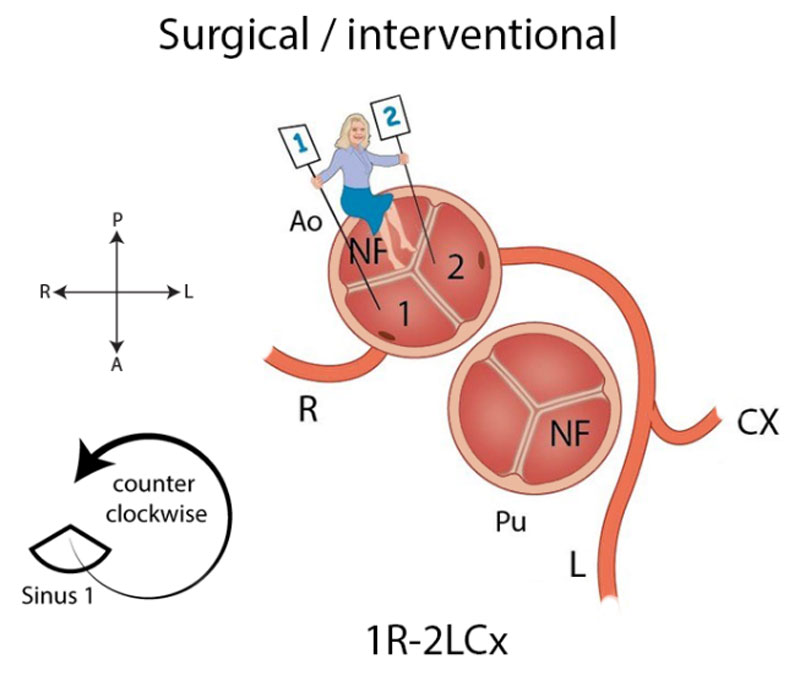
In het chirurgische systeem gaat de arts in de aortaklep zitten en neemt plaats in de ‘sinus’ die niet aan de pulmonalisklep grenst met de benen naar binnen toe (zie Afbeelding 2). Deze sinus heet de ‘non-facing sinus’. Aan de rechterhand bevindt zich sinus 1 en aan de linkerhand sinus 2. Vanaf de positie in de non-facing sinus kijkt de arts in de richting van de pulmonalisklep. Vanaf daar wordt tegen de klok in opgeschreven welke kransslagaders men tegenkomt. R is de RCA, L is de ‘ramus anterior descendens’ of LAD en Cx is de ‘ramus circumflex’. Deze laatste twee kransslagader vormen samen de LCA. Als de kransslagaders uit de verschillende sinussen komen, wordt een streepje gezet tussen beide kransslagaders met ervoor het nummer van de sinus waaruit ze afgaan, zoals in Afbeelding 2: 1R-2LCx betekent: de RCA komt uit sinus 1, en de LCA uit sinus 2. Als de kransslagaders gescheiden uit dezelfde sinus komen, wordt er een komma tussen gezet. Als ze als 1 vat uit dezelfde sinus komen, wordt er niets tussen gezet (zoals bij de Cx die uit de L komt, zie Afbeelding 2). In het geval van een kransslagader die tussen de aorta en pulmonalisarterie doorloopt, wordt er bij dat vat een sterretje gezet. Hieronder staan 2 voorbeelden (Afbeelding 3):
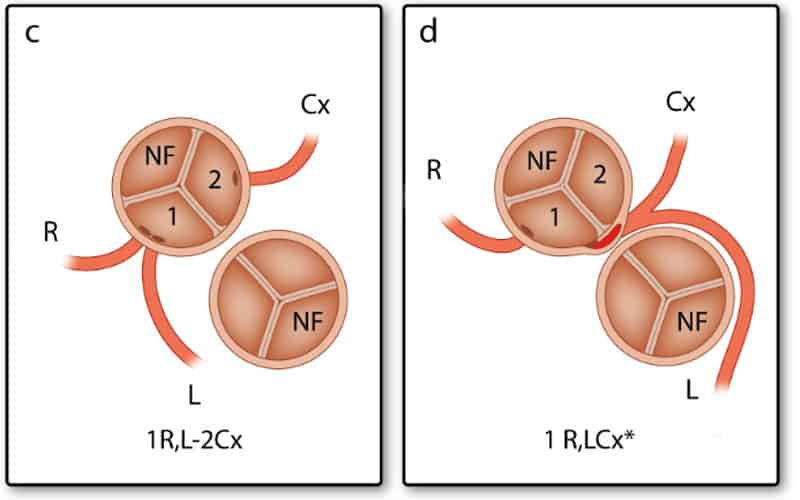
Andere bijzonderheden die niet verwerkt kunnen worden in deze annotatie, worden vervolgens apart vermeld.
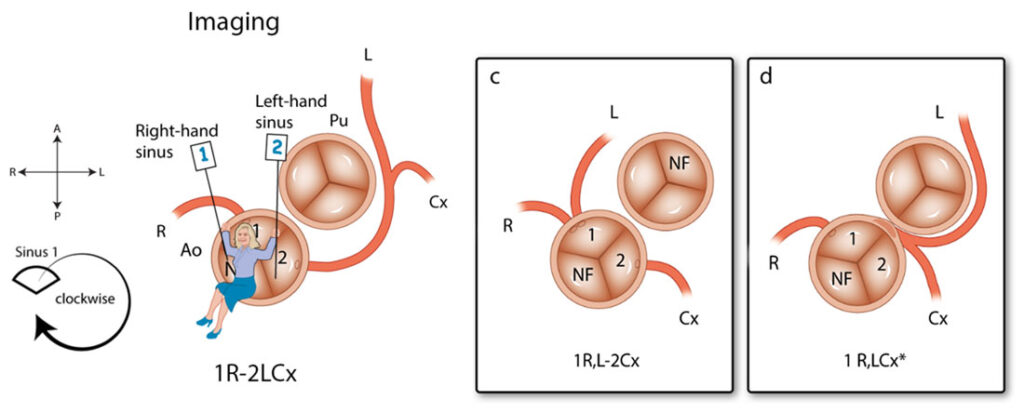
Voor het systeem voor beeldvorming (=imaging), zoals CT-scan en echocardiografie, is de methode gespiegeld. De arts gaat ook nu weer in de non-facing sinus zitten, maar nu met de benen naar buiten. Op deze manier is de sinus aan de rechterhand weer sinus 1 en aan de linkerhand sinus 2 (Afbeelding 4). In plaats van tegen de klok in wordt nu met de klok mee gedraaid. Opnieuw worden de kransslagaders benoemd in de volgorde waarin ze worden tegengekomen. Wat betreft het plaatsen van streepjes en komma’s in de annotatie geldt hetzelfde als voor de chirurgische methode.
Met dit Leiden Convention coronair coderingssysteem kan dus bij bijna iedereen de kransslagaderanatomie op dezelfde duidelijke manier worden opgeschreven. Zo kunnen chirurgen en (kinder)cardiologen gemakkelijker in één oogopslag de kransslagaderanatomie beoordelen.
Voor meer informatie zijn is de onderstaande publicatie van het Leiden Convention coronair coderingssysteem beschikbaar: https://academic.oup.com/ehjcimaging/advance-article/doi/10.1093/ehjci/jeab012/6135324. Dit artikel is ook de bron van de bovenstaande afbeeldingen.

